导读
意凯真空均质乳化机小编认为对于关键的除菌级过滤工艺而言,完整性测试是确保过滤工艺安全性的一种必要手段。通过完整性测试,可以确定过滤器自身的完整性,并确保工艺中安装了正确的过滤器,还可以确保过滤系统的密闭性等。同时,进行完整性测试也是各国法规的强制要求。
相关规定
- 中国GMP2010版附录1无菌药品第九十四条规定:“除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。常用的方法有起泡点试验、扩散流试验和压力保持试验。过滤工艺验证中应确定过滤一定量药液所需时间及过滤器两侧的压力,任何明显偏离正常时间或压力的情况应有记录并进行调查,调查结果应归入批记录。”
- 欧盟GMP附录1无菌药品的生产第一百一十三条规定:“已灭菌的过滤器的完整性需要使用适当的方法,在过滤前进行确认,并需要在使用后立刻进行确认,测试方法包括起泡点、扩散流或压力保持测试。过滤工艺验证中应确定过滤一定量药液所需时间及过滤器二侧的压力;任何明显偏离正常时间或压力的情况应有记录并进行调查,调查结果应归入批记录。关键气体和空气过滤器的完整性需要在使用后确认,其他过滤器的完整性需要定期进行检测”。
- FDA在《无菌药品生产工艺指南》中规定:“对于由一个或多个滤器组成的过滤系统,应该包括在最差生产条件下进行的微生物挑战试验的验证”。过滤器的完整性检测可以在使用前进行,并且应当在使用后常规进行。过滤后进行完整性检测是非常重要的,可以探査到过滤器在使用过程中可能发生的任何泄漏或者穿孔。当正确使用时,扩散流和气泡点是两种可以使用的完整性检测方法。成品过滤器的完整性检测规范应当与细菌截留验证研究的数据保持一致。
- 《PDA技术报告(26版)》规定:“现行的GMP要求过滤器及过滤系统在使用前及使用后均需要进行完整性测试”。
完整性测试方法
完整性测试方法分为破坏性和非破坏性两大类(图2.70)。对于供应商而言,破坏性完整性测试结果是供应商作为每批产品放行的标准;对于客户而言,则需要在除菌过滤器验证时进行破坏性测试(细菌挑战测试),测试中采用实际工艺料液并在最差工艺条件下进行。
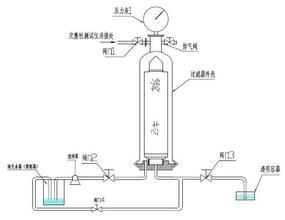
图2.70完整性检测示意图
非破坏性完整性测试
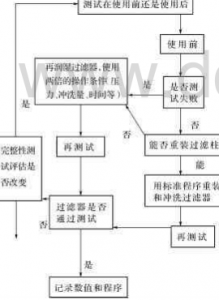
非破坏性完整性测试的主要目的是在不损坏过滤器的前提下确定是否存在可能危及过滤器截留能力的缺陷,它需要供应商在出厂时及客户在使用现场进行操作。非破坏性完整性测试方法主要包括基于毛细管原理的起泡点(Bubblepoint)和水浸入法(HydroCorr)测试,以及基于扩散原理的扩散流(Diffusion)和压力保持/衰减(Pressurehold/decay)测试。一旦完整性测试失败,可采用图2.71所示的措施方法进行处理。
图2.71完整性检测失败后的处理措施
破坏性试验
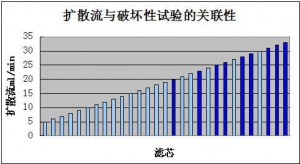
对除菌级过滤器而言,破坏性测试是指细菌挑战测试,该测试方法是证明过滤器能够满足苛刻的除菌级过滤器标准的根本方法,属于除菌级过滤器完整性检测的“金标准”。在细菌挑战测试中,需根据统计学原理从每批产品中抽取一定数量的样品,按照标准测试方法,利用缺陷假单胞菌溶液(Brevundimonasdiminuta,ATCC19146)进行细菌挑战测试,过滤器需要达到至少107cfu/cm2滤膜的细菌截留,才可认为该滤器为除菌级过滤器。细菌挑战测试是一种破坏性试验,不能用来证明将用于生产的过滤器的完整性。破坏性和非破坏性测试两者必须有关联,以扩散流试验为例(图2.72),用户的完整性检测限值需低于供应商的破坏性试验值。
图2.72扩散流和破坏性试验的关联性