验证步骤
除菌级过滤器的截留细菌能力需要被验证。过滤器的验证包括两部分,由均质乳化机小编为你介绍:
- 一部分是由过滤器生产商在过滤器制造过程中完成,
- 另一部分需由客户在确定工艺时进行。
前者的验证是制造商用含有高于107cfu/cm2浓度缺陷性假单胞菌(ATCC19146)的标准溶液在制造商设定的条件下进行截留验证,不同材质的滤膜挑战条件都是一样的;
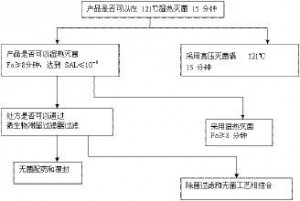
后者是制药企业根据其实际工艺和实际料液进行的细菌截留验证,同一款滤膜针对不同药液在不同工艺条件下的验证结果是不同的。图2.68为《药品GMP指南》中关于除菌过滤器的工艺验证决策树。
图2.68除菌过滤的工艺验证决策树
气体过滤器的应用
气体过滤器在制药流体工艺系统中也有着广泛的应用,例如,配液罐的呼吸器、制药用水罐上的呼吸器,完整性检测用的无菌气体过滤器、压料用的无菌气体过滤器。
如前所述,气体过滤器的工作机理主要为大小排除原理与扩散拦截原理,在潮湿的环境下,吸附拦截不起作用。FDA工业指南《用无菌工艺生产的无菌药品》中规定:气体过滤器(包括呼吸过滤器)应当保持干燥,气体过滤器出现冷凝物可导致过滤器使用期间出现阻塞,或导致微生物增加。
使用疏水性过滤器,以及在适当时为这些过滤器进行加热,可防止难以解决的残余水分的形成。对于高温操作环境的罐体呼吸器,可采用安装电加热或蒸汽加热夹套的方式解决冷凝水的聚集(图2.69)。
图2.69带电加热夹套的呼吸器
气体除菌过滤器的分类
对于气体除菌过滤器的细菌截留要求尚没有统一的标准。按照关键程度,气体过滤器的应用分为三类:
- 第一类是直接与无菌产品进行接触的气体过滤器,如用于无菌灌装的氮气;
- 第二类为间接与产品接触的气体过滤器,如水罐与配液罐体的呼吸器;
- 第三类为降低微生物负荷的过滤器,如HEPA高效过滤器。气体过滤器的质量风险等级与使用、维护与管理法密切相关,表2.5中列举了几种常见的气体过滤器操作方法,其风险等级从上到下逐渐增加。
表2.5气体过滤器的风险等级与管理
| 风险等级 | 操作、维护与管理方法 |
| 1 | 平行安装过滤器,当其中一个在使用时,另外一个可以进行完整性检测和使用前的灭菌等准备,例如,注射用水罐安装两个平行的呼吸器 |
| 2 | 使用冗余过滤器,如两个过滤器串联安装,并采用定期完整性检测和定期更换相结合的方法 |
| 3 | 定期完整性检测和定期更换,结合使用 |
| 4 | 只在第一次灭菌后进行完整性检测 |
| 5 | 只在安装完成后进行完整性检测 |
| 6 | 不检测完整性,只依靠历史数据确定更换周期 |