导读:
本文针对GMP实施的发展策略进行系统论述,以下由意凯制药乳化机设备小编为大家带来笔者的分享~
通过比较1998年版和2010年版GMP的差异,分析外用药物制剂生产企业在实施GMP的基本要求,在2010年版GMP高标准、高要求的管理作用下,强调质量管理体系中软件和硬件管理的建设,从生产质量管理的各个环节着手,全面提高药品质量。随着2010年版GMP的实施,对药品生产在管理范围、管理理念及生产质量管理标准等方面均有了显著提升。从外用药物制剂生产企业实施GMP的生产工艺验证、清洁验证软件策略措施等方面分析,结合外用药物制剂生产企业的自身特点及国家实施监督GMP准入条件的提高和退出机制的完善,企业应当找准自己的方向,理性对待GMP改造,不要盲目实施;在有效的GMP认证准备工作中,制定周密的GMP改造计划,为高效实施GMP做冲刺准备,解放思想,将认证过关的思想转变为全称控制的理念,建立完善的质量保证体系。
1、外用药物制剂的分类
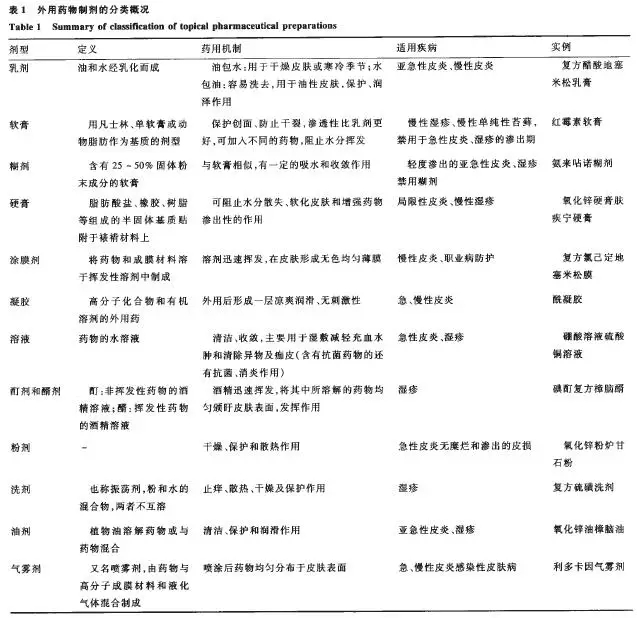
由于外用药物制剂使用较为便捷,可通过局部给药,缓解症状,达到局部治疗作用或经皮吸收达到全身治疗的作用。从广义的角度来看,凡是不经过口服、注射,可直接作用于皮肤、黏膜或腔道的药物;从狭义的角度上看,规定用于皮肤、黏膜或腔道的药物,同时包装及标签上印有外用药物制剂的标识,统称为外用药物制剂。外用药物制剂囊括了绝大部分剂型,包括一些常用的口服固体制剂,如散剂、片剂等均可外用,说明外用药物制剂具有普遍性和广泛性,见表1。
2、外用药物制剂生产企业实施GMP的要求
与1998年版GMP相比,意凯无菌乳化机设备小编觉得2010年版GMP具有较好的科学性和优越性。提出药品GMP管理的原则和监管理念,具有指导性、可检查性、可操作性贯穿在药品生产的全部过程;强调了药品GMP实施的实事求是原则,重点是“软硬并重”,突出强调了文件管理的重要性和规范性,具有国际GMP先进理念。外用药物生产企业要符合药品GMP的各种规定(无菌外用制剂除外),需满足2010年版GMP内容中相对较低的要求。
2.1
结构框架与1998年版GMP相比,2010年版GMP增加了条款数量,由88条增加至313条,并且细化了各项规定,使得规范的结构更加清晰了,增强了规范的可操作性;新增了质量控制和质量保证,完善了质量管理体系相关条款。
2.2
GMP架构与管理企业的生产管理负责人、质量管理负责人作为“关键人员”开展了职责定位及岗位职责明确。
新增质量受权人的职责与权限,并对其资质进行了规定。另对人员培训方面作出了一些更加严格的规定,强调了的独立性监管机构及其职责的特殊性。公司在人员方面必须到位,以保证工作人员的主导因素。
2.3
物料与产品管理将1998年版的“物料”修订为“物料与产品”,这一表述更加全面、精准。新版GMP结束了供应部门单方面或无统一流程进行物料采购的时代,增加了药品标签和说明书上的规定使用。此外,材料的验收、存储、分发和处理尾料需要经特殊明确的条款进行,意凯GMP级乳化机设备小编认为,这表明药品GMP在保证生产质量方面的重要性日益增加。强调了检测原料和材料供应商审计质量控制的重要性,继续使企业管理标准化,以避免引起个体行为的随意性,避免随意性导致的不利影响。外用药物制剂生产企业应当更加重视这个问题,保证药品生产源头的质量,杜绝一切投机行为。
2.4
文档管理的原则文件内容必须与药品生产许可、药品注册等相关要求的内容一致,增加了法定规定条款,所需文件应定期复査、修改,这限制了为了自己方便而变更相关技术文档和其他内容的行为,这种现象更可能发生在外用药物制剂。增加材料的质量标准和成品质量要求等内容,细化了生产过程中批生产记录、工艺规程及包装记录的内容,可避免企业文件中的盲目性和形式主义。
2.5
生产管理科学分析了药品生产管理的内涵,特别在包装操作的管理方面,充分体现了控制整个生产过程的系统性和管理系统的完整性。关于采取措施防止污染,并在生产过程和交叉污染的处理方面进行了详细阐述,共有11个条款来解释,可进行加强和补充,这些措施应定期检查和评估其适用性和有效性,使操作更加规范化。
2.6
质量管理包含质量控制和质量保证。从质量保证、质量目标、质量风险管理和质量控制制度4个方面人手,更加丰富了质量管理的内涵,使质量的广度和深度得到提高,并把提高管理的质量作为一个系统概念。变更控制是药品生产和登记的终端,确保质量,防止随性操作。偏差处理是监督企业管理的方法,需要严格执行文件的要求;产品质量分析评价可促进企业注重产品质量、掌握先进科学方法及丰富内容管理,有助于GMP在该公司的贯彻落实。
3、外用药物制剂生产企业实施GMP的措施分析
外用药物制剂生产企业在进行药品GMP改造中,应充分考虑厂区整体规划和布局,合理设计人和物流通道,减少物流输送的距离,避免交叉污染。根据未来发展及生产要求,适当预留生产空间。外用药物制剂车间的药品GMP布局必须依循物和人分流、洁净级别、工艺布局的合理原则。药品GMP布局要求具有单独的净化使用室。
3.1
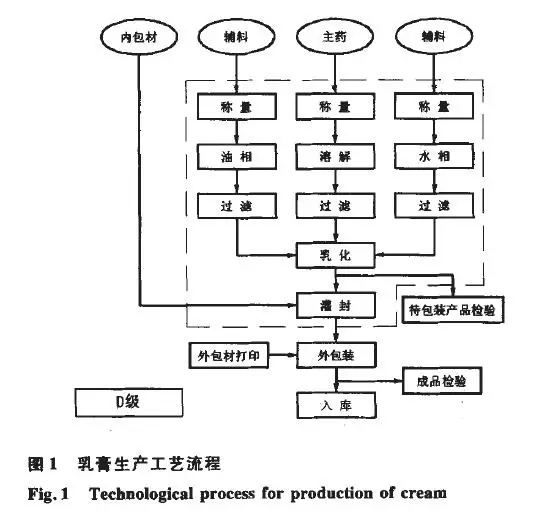
生产车间的布局设计应与剂型的生产工艺流程一致,工艺布局按药品GMP要求,结合项目的实际情况,做到结构紧凑,按工艺流程合理布局,严格分区,生产区分为一般的生产区,D级洁净区,C级洁净区,B级洁净区及局部A级洁净区。以乳音为例,其生产流程见图1。外包装的清洁和检验等除外,其余区间均必须是洁净的生产区。辅料和原料的外包装经过消毒或清洁后,必须经过气闸室和传递窗才可以放置到原辅料暂存的房间。辅料和原料严格按照生产指令、工艺要求进行精密称定质量后转运配制间,油溶性的处方量原、辅料输送到油相锅进行加热熔融,水溶性的处方量原、辅料输送到水相锅进行加热和溶解,经过筛网的过滤后,通过真空泵将物料吸人真空乳化机内,按工艺要求进行保温。物料通过刮板搅拌、均质乳化、冷却等处理后,转移至产品储罐或周转桶中。产品转移到中间站后,等其冷却和老化后开始抽样送检。各项质量检测指标确认合格后方可放行转人下道工序。
3.2
生产车间的药品GMP布局厂房需要根据洁净度进行布局和调整,这与GMP标准中提及的改造空调系统有关。2010年版药品GMP提出了更高的要求去引导厂房布局,并调整某些操作的具体环境。外用药物制剂车间的布局,必须要人、物分流,人流和物流必须经过各自的净化通道净化后才可进入洁净区。根据新版GMP要求,应不交叉和不混淆地建立洁净区,含有激素软音的原料配制、称量、搅拌、乳化机乳化、灌装等程序,从生产工艺布局角度考虑,必须安排在隔离房间进行。一级和二级更衣室亦有明确区别,以保证更衣后段的静态级别与相应洁净级别相匹配。外用药生产车间洁净区内需要较高标准的间隔,主要用50mm夹芯钢板进行各操作间的装修和布置。
3.3
空气净化系统药品GMP对洁净区的微生物和悬浮粒子提出了更高要求。空气净化系统由空气处理及过滤构成。过滤器分为初、中、亚高和高效过滤器,使进入洁净区域的空气达到GMP规定的洁净级别要求,减少不良物质对产品质量造成的影响,实现空气过滤的目的。激素类和无菌外用药物制剂,如应用于烧伤或严重创伤用药,需要按无菌药品制剂的洁净区级别使用无菌乳化机设备进行生产。
3.4
空气净化系统的要求制造含有激素成份的外用药物时,应严格过滤厂房和生产区间的送风与回风,高效过滤器应该设置在送风口的尾端,中效以上的过滤器应该设置在回风口上端,以净化排风,防止各种产品间的粉尘交叉污染。生产激素类和非激素类的乳裔(软膏)时必须将配制、称量、灌封的回风全部排放,以杜绝或防止激素类药物的微粒交叉污染其他的非激素乳膏(软青)。
3.5
设备更新与改进。2010年版药品GMP对设备未提出太多的要求,但对软件管理和环境洁净度提出了许多要求,这就要求企业必须去提高生产设备的性能。以软膏制备为例,现阶段生产软膏的主要设施为配制和灌封设备,如真空均质乳化机、自动灌封机和自动打包机等。